Vous êtes ici :
- Unité de recherche
- BioCIS
- Accueil
- Thèmes de recherche
- Molécules fluorées
- Acides aminés fluorés énantiopurs
Acides aminés fluorés énantiopures
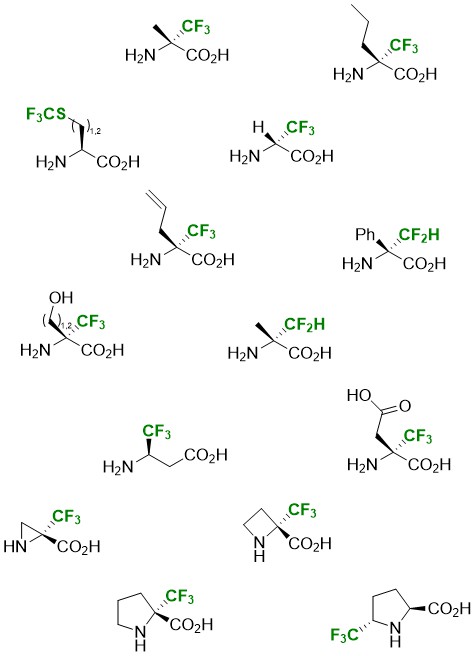
Les aminoacides fluorés sont des cibles très intéressantes puisqu’ils confèrent des propriétés physiques et biologiques nouvelles aux molécules dans lesquelles ils sont incorporés. Toutefois, leur préparation sous forme énantiopure reste un enjeu, ce qui explique leur faible utilisation à ce jour. Notre laboratoire a développé plusieurs voies d’accès pour la préparation d’aminoacides sous forme énantiopure, toutes basées sur l’utilisation d’un intermédiaire commun : les oxazolidines fluorométhylés chirales (FOX). Ces composés particulièrement stables sont obtenus à partir de dérivés fluorés et de différents aminoalcools chiraux commerciaux (en général, le (R)-phénylglycinol).
Voie Strecker
La première voie de synthèse est basée sur la mise en œuvre d’une réaction de Strecker. Une étude méthodologique a été réalisée à partir d’imines ou d’oxazolidines trifluorométhylées chirales, en faisant varier la nature de l’acide de Lewis et de la copule chirale. Bien que la diastéréosélectivité de la réaction soit moyenne, la séparation des deux diastéréoisomères est simple. Cette stratégie a permis la synthèse de la (R)-(+)-trifluoroalanine ainsi que celle des deux énantiomères de l’α-Tfm-alanine, de l'acide α-Tfm-aspartique et de l'α-Tfm-sérine.
- Selection de publication
-
1. Lewis acid activation of chiral 2-trifluoromethyl-1,3-oxazolidines. Application to the stereoselective synthesis of trifluoromethylated amines, alfa- and beta-amino acids, Lebouvier, N. ; Laroche, C. ; Huguenot, F. ; Brigaud, T. Tetrahedron Lett. 2002, 43, 2827-2830.
2. Concise synthesis of enantiopure alfa-trifluoromethyl alanines, diamines and amino alcohols via the Strecker-type reaction, Huguenot, F. ; Brigaud, T. J. Org. Chem. 2006, 71, 7075-7078.
3. Concise Synthesis of Enantiopure (S)- and (R)-alpha-Trifluoromethyl Aspartic Acid and alpha-Trifluoromethyl Serine from Chiral Trifluoromethyl Oxazolidines (Fox) via the Strecker-type Reaction, Simon, J.; Nguyen, T. T.; Chelain, E.; Lensen, N.; Pytkowicz, J.; Chaume, G.; Brigaud, T. Tetrahedron : Asymmetry 2011, 22, 309-314.
4. Straightforward Synthesis of Novel Enantiopure α-Trifluoromethylated Azetidine 2-Carboxylic Acid and Homoserines. Lensen, N.; Marais, J.; Brigaud, T. Org. Lett. 2015, 17, 342-345
5. Synthesis of Enantiopure trans-2,5-Disubstituted Trifluoromethylpyrrolidines and (2S,5R)‑5-Trifluoromethylproline. Lubin, H.; Pytkowicz, J.; Chaume, G.; Sizun-Thomé, G.; Brigaud, T. J. Org. Chem. 2015, 80, 2700-2708
6. Enantiopure α-Trifluoromethylated Aziridine-2-carboxylic Acid (α-TfmAzy): Synthesis and Peptide Coupling. Ouerfelli, O.; Simon, J.; Chelain, E.; Pytkowicz, J.; Besbes, R.; Brigaud, T. Org. Lett. 2020, 22, 2946-2949.
7. Synthesis of enantiopure α-Tfm-proline and α-Tfm-pipecolic acid from oxazolo-pyrrolidines and -piperidines. C. A. Sanchez, C. Gadais, S. Diarra, A. Bordessa, N. Lensen, E. Chelain and T. Brigaud, Org. Biomol. Chem., 2021, 6771-6775
Voie Mannich/Reformatsky
Une addition de type Mannich via l’addition d’un acétal de cétène silylé en présence d’acide de Lewis donne accès, après séparation des diastéréoisomères, au (R)-β-trifluorométhyl-β-aminoacide correspondant sous forme énantiopure. L’utilisation du réactif de Reformatsky fournit l’α-Tfm-β-lactame, précurseur du β-trifluorométhyl-β-aminoacide.
- Selection de publication
-
Convenient asymmetric synthesis of beta-trifluoromethyl-beta-amino acid, beta-amino ketones and gama-amino alcohols via Reformatsky and Mannich type reactions from 2-trifluoromethyl-1,3-oxazolidines, Huguenot, F. ; Brigaud, T. J. Org. Chem. 2006, 71, 2159-2162.
Voie Allylsilane
Nous avons développé une seconde voie de synthèse d’α-Tfm AAs originaux basée sur l’utilisation d’une allylmorpholinone α-trifluorométhylée. Plusieurs grammes de cet intermédiaire clé peuvent être obtenus en deux étapes à partir de l’imine ou de l’oxazolidine dérivée du trifluoropyruvate d’éthyle via une réaction d’allylation. Après séparation des deux diastéréoisomères, la (S)-α-Tfm-α-allylglycine ainsi que la (S)-α-Tfm-norvaline ont été obtenues de façon énantiopure. L’incorporation de la chaîne allylique a également permis la synthèse de divers α-Tfm AAs à motif pyrrolidine. Une séquence hydroboration-aminocyclisation a permis la synthèse de chaque énantiomère de l’α-Tfm-proline. La mise en oeuvre d’une séquence hydroboration-oxydation-aminocyclisation conduit à chaque énantiomère de l’α-Tfm-pyroglutamique. Nous avons régalement décrit une réaction d’iodocyclisation à partir de l’allylmorpholinone qui a également conduit aux deux énantiomères de l’α-Tfm-proline. Les dérivés iodés intermédiaires peuvent être engagés dans une séquence élimination-dihydroxylation pour conduire de façon complétement diastéréosélective aux α-Tfm-prolines dihydroxylés énantiopures.
- Sélection de publications
-
1. Straightforward synthesis of (S)- and (R)-alfa-trifluoromethyl proline from chiral oxazolidines derived from ethyl trifluoropyruvate, Chaume, G., Van Severen, M.-C., Marinkovic, S. ; Brigaud, T. Org. Lett. 2006, 8, 6123-6126.
2. Concise access to enantiopure (S)- and (R)-α-trifluoromethyl pyroglutamic acids from ethyl trifluoropyruvate-based chiral CF3-oxazolidines (Fox), Chaume, G. ; Van Severen, M. -C. ; Ricard, L. ; Brigaud, T. J. Fluorine Chem. 2008, 129, 1104-1109.
3. Iodocyclization of Chiral CF3-Allylmorpholinones : A Versatile Strategy for the Synthesis of Enantiopure alfa-Tfm-Prolines and alfa-Tfm-Dihydroxyprolines, Caupène, C. ; Chaume, G. ; Ricard, L. ; Brigaud, T. Org. Lett. 2009, 11, 209-212.
Voie Difluoroénoxysilane
En collaboration avec l’équipe du professeur Charles Portella (Université de Reims Champagne Ardenne, UMR 6519), la réactivité des oxazolidines difluorées chirales a été étudiée pour accéder aux α-Dfm-aminoacides via la réaction de Strecker. Après séparation des diastéréoisomèrs, la (S)-α-Dfm-alanine et la (R)-α-Dfm-alanine sont obtenues sont forme énantiopure.
- Sélection de publication
-
Umpolung reactivity of difluoroenol silyl ethers with amines and amino alcohols. Application to the synthesis of enantiopure alfa-difluoromethyl amines and amino acids, Huguenot, F. ; Billac, A. ; Brigaud, T. ; Portella, C. J. Org. Chem. 2008, 73, 2564-2569.


