Vous êtes ici :
- Unité de recherche
- BioCIS
- Accueil
- Thèmes de recherche
- Peptidomimétiques
- Peptides fluorés
Peptides fluorés
Une des limitations à l’utilisation des peptides comme agents thérapeutiques est leur dégradation rapide par les peptidases ainsi que leur faible lipophilie. Notre laboratoire s’intéresse à la mise au point de réactions de couplage peptidique efficace qui permettent l’incorporation d’aminoacides α-trifluorométhylés énantiopurs dans des chaînes peptidiques. Leur utilisation est d’un grand intérêt du fait des propriétés uniques de l’atome de fluor. Leur incorporation dans des chaînes peptidiques est prometteuse du fait des contraintes conformationnelles, des effets électroniques et de l'augmentation de l'hydrophobie induits par les groupements fluorés. Ainsi une stabilité métabolique accrue vis-à-vis des protéases et des structures tridimensionnelles originales sont attendues. L'augmentation local du charactère hydrophobe peut permettre de faciliter le passage de la barrière hémato-encéphalique. Par ailleurs ces peptides fluorés présentent un fort potentiel analytique en tant que sonde RMN (19F) pour l’élucidation des structures, la compréhension des mécanismes biologiques et les études pharmacocinétiques de ces peptides non protéogéniques.
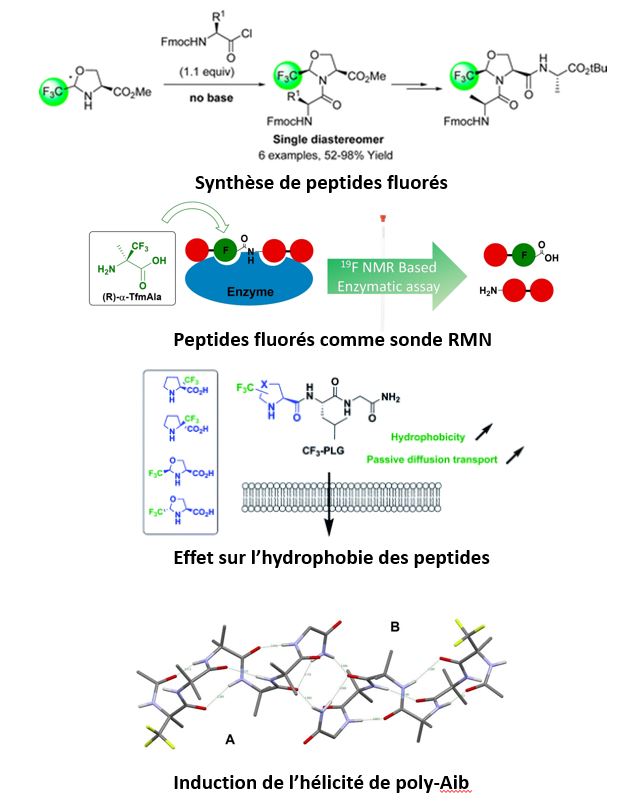
Nous avons récemment développé une méthode efficace pour la synthèse de dipeptides N-terminaux à partir d’α-Tfm-Alanine et d’α-Tfm-Proline non protégé utilisant les conditions de couplage peptidique classique HOBt, EDCI. La synthèse de dipeptides C-terminaux est beaucoup plus délicate du fait de la forte désactivation de l'azote par le groupement CF3. Une étude méthodologique réalisée à partir de pseudoprolines trifluorométhylées chirales a permis d'effectuer la réaction de couplage avec des acides aminés activés sous forme de chlorures d'acyle. L'optimisation des conditions réactionnelles est en cours au laboratoire et elles sont appliquées à la synthèse de divers peptides d'intérêts.
- Sélection de publications
-
1. Introducing the chiral constrained α-trifluoromethylalanine in aib foldamers to control, quantify and assign the helical screw-sense, Bodero, L., Guitot, K., Lensen, N., Lequin, O., Brigaud, T., Ongeri, S., Chaume, G. Chemistry - A European Journal, 2022, ASAP article
2. (R)-α-Trifluoromethylalanine as a 19F NMR Probe for the Monitoring of Protease Digestion of Peptides. Devillers, E.; Chelain, E.; Dalvit, C.; Brigaud, T.; Pytkowicz, J., ChemBioChem 2022,23, e202100470
3. Enantiopure 5-CF3–Proline: Synthesis, Incorporation in Peptides, and Tuning of the Peptide Bond Geometry. C. A. Sanchez, C. Gadais, C.;Chaume, G.; Girard, S.; Chelain, E.; Brigaud, T. Org. Lett. 2021, 382-3874. Trifluoromethylated Proline Surrogates as Part of "Pro-Pro" Turn-Inducing Templates. Gadais, C.; Van holsbeeck, K.; Moors, S. L. C.; Buyst, D.; Feher, K.; Van Hecke, K.; Tourwe, D.; Brigaud, T.; Martin, C.; De Proft, F.; Pytkowicz, J.; Martins, J. C.; Chaume, G.; Ballet, S. ChemBioChem 2019, 20, 2513-2518.
5. CF2H as hydrogen bond donor group for the fine tuning of peptide bond geometry with difluoromethylated pseudoprolines. Malquin, N.; Rahgoshay, K.; Lensen, N.; Chaume, G.; Miclet, E.; Brigaud, T. Chem. Commun. 2019, 55, 12487-12490.
6. Trifluoromethylated proline analogues as efficient tools to enhance the hydrophobicity and to promote passive diffusion transport of the L-prolyl-L-leucyl glycinamide (PLG) tripeptide. Oliver, M.; Gadais, C.; Garcia-Pindado, J.; Teixido, M.; Lensen, N.; Chaume, G.; Brigaud, T. RSC Adv. 2018, 8, 14597-14602.
7. Probing the outstanding local hydrophobicity increase of peptide sequences induced by trifluoromethylated amino acids incorporation. Gadais, C.; Devillers, E.; Gasparik, V.; Chelain, E.; Pytkowicz, J.; Brigaud, T. ChemBioChem 2018, 19, 1026–1030.
8. Tailored Approaches towards the Synthesis of L-S-(Trifluoromethyl)cysteine- and L-Trifluoromethionine-Containing Peptides. Gadais, C.; Saraiva-Rosa, N.; Chelain, E.; Pytkowicz, J.; Brigaud, T. Eur. J. Org. Chem. 2017, 246-251.
9. Homochiral versus Heterochiral Trifluoromethylated Pseudoproline Containing Dipeptides: A Powerful Tool to Switch the Prolyl-Amide Bond Conformation. Chaume, G.; Simon, J.; Lensen, N.; Pytkowicz, J.; Brigaud, T.; Miclet, E. J. Org. Chem. 2017, 82, 13602-13608.10. Synthesis of protected enantiopure (R) and (S)-α-trifluoromethylalanine containing dipeptide building blocks ready to use for solid phase peptide synthesis. Devillers, E.; Pytkowicz, J.; Chelain, E.; Brigaud, T. Amino Acids 2016, 48, 1457-1468.
11. Incorporation of CF3−Pseudoprolines into Peptides: A Methodological Study, Chaume, G.; Simon, J.; Caupène, C.; Lensen, N.; Miclet, E.; Brigaud, T. J. Org. Chem. 2013, 78, 10144-10153.


